Kirjoittaja: Ari Kaihola
Sisällysluettelo
1.
– Linkki Helsingin Yliopiston luentoon Elämäntapani voivat tuhota maksani
– Runsaasti rottakokeita, joissa alkoholia nauttiville rotille annettu tyydyttynyt rasva pelasti niiden maksat ja monityydyttymätön tuhosi ne
– Tyydyttynyt rasva lievitti myös parasetamolin aiheuttamia haittoja
2.
– Ei-alkoholiperäinen rasvamaksa ja sen hoito
– Tyydyttyneiden- sekä monityydyttymättömien rasvojen ja hiilihydraattien rooli rasvamaksassa
– Ketoosi parannuskeinona
3.
– Siemenöljyt ja niiden hapetustuotteiden myrkyllisyys
– Tyydyttyneiden rasvojen vakaus – esimerkkinä McDonalds
– Siemenöljyjen hapetustuotteiden 4-HNE ja 4-HHE osuus maksasairauksissa
– Miksi monityydyttymättömiin rasvoihin perustuvaa ketogeenista dieettiä ei voi suositella
4.
– Monityydyttymättömien rasvojen hapetustuotteiden historiaa solutasolla
– Elimistön puolustusmekanismit 4-HNE ja 4-HHE myrkkyjä vastaan ja niiden riittävyys
– Myrkylliset aldehydit elintarvikkeissa – miten välttää saamasta niitä?
– Oman torjuntakyvyn tehostaminen (glutationisynteesi)
Vietämme maksaviikkoa 2.-6.11.2020 ja sen kunniaksi sinun on hyvä lukea tämä kirjoitus.
Paluu menneisyyteen
Alkoholimaksan ja rasvamaksan yhteisten nimittäjien etsiminen pitää aloittaa 1,5 miljardin vuoden päästä menneisyydestä.
Mutta eihän ihmistä ollut silloin edes olemassa!? Ei ollutkaan, mutta silloin ilmakehään oli jo kertynyt hieman happea ja alkeellisten eliöiden piti sopeutua sen tappavaan vaikutukseen. Tuolloin oli jo olemassa bakteereja ja yksisoluisia alkueläimiä. Ne päättivät lyödä hynttyyt yhteen ja saivat siitä kilpailuedun eloonjäämiskamppailussa: bakteerit tuottivat entistä enemmän energiaa ja käyttivät happea tuotannon tehostamiseen; yksisoluiset tarjosivat ilmeisesti ulkoisilta uhkilta paremmin suojaavan ympäristön. Niistä tuli eukaryootteja (aitotumaiset), jotka pärjäsivät paremmin kuin kumpikaan eliö erikseen. Bakteerit saivat uuden nimen, mitokondrio. Energian tuottaminen happea hyväksikäyttäen kuitenkin aiheutti ongelman: eri lähdeaineet tuottivat vaihtelevan määrän myrkkyjä (hapettuneita yhdisteitä). Ne piti neutraloida, että koko solu ei kuolisi. No, onneksi ne onnistuivat toimivan menetelmän kehittämisessä, koska ilman sitä ei meitäkään olisi.
Samat bakteerien jälkeläiset jauhavat energiaa vielä tänäkin päivänä melkein jokaisessa meidän solussamme, myös maksasoluissa. Ja samat 1,5 miljardia vuotta vanhat puolustusmekanismit tekevät työtä vuorotta edelleen pitääkseen solut hengissä ja hyvinvoivina. Tätä kuvataan hyvin katsausartikkelissa Rasvojen hapetustuotteen, 4-HNE:n rooli syövässä: keskiössä mitokondriot (1). Se sisältää niin onnistuneen kuvauksen noista em. yhteisistä nimittäjistä, että on paikallaan kääntää kohtalaisen pitkä pätkä tekstistä alkaen ao. väliotsikon jälkeisestä kappaleesta:
”4-HNE:n muodostus ja hajotus mitokondrioissa
On yleisesti hyväksytty, että 4-HNE:tä muodostuu omega-6 monityydyttymättömien rasvojen hapetustuotteiden hajoamisesta solukalvoilla (Fig. 1A). Siten solukalvojen fosfolipidit, jotka sisältävät linolihappoa (LA, 18:2 n-6) ja arakidonihappoa (AA, 20:4 n-6) katsotaan olevan pääasiallinen 4-HNE:n lähde. Uudemmat tuloksemme osoittavat kuitenkin, että mitokondrioiden kardiolipinin hapettuminen johtaa myös huomattavaan määrään 4-HNE:tä ja muita hapetustuotteita mekanismilla, johon liittyy erilaisten hiiliketjujen happiradikaalien ristisidoksia ja hajoamisia.” ja
”On olemassa kolme pääasiallista detoksifikaatiota, jotka muuttavat 4-HNE:n vähemmän reaktiivisiksi kemikaaleiksi ja valvovat niiden solunsisäistä tasapainoa (Fig. 2).
- Ensimmäiseksi tulee tärkein hajotusreaktio, sidosten muodostaminen glutationin (GSH) kanssa. Se tapahtuu spontaanisti ja sitä voivat kiihdyttää glutationi-transferaasi (GST) entsyymit.
- Toiseksi, 4-HNE:tä pelkistää myös joko aldo-keto reduktaasit (AKR) tai alkoholi dehydrogenaasit (ADH).
- Kolmanneksi, 4-HNE voi hapettua edelleen HNA:ksi aldehyde dehydrogenaasin (ALDH) vaikutuksesta.
Läpi yli 1,5 miljardin vuoden yhteiselon yksisoluisen kanssa, mitokondriot ovat kehittäneet monimutkaisen järjestelmän aistimaan ja reagoimaan oksidatiiviseen stressiin isäntänsä tapaan.
Glutationi (GSH) on yksi tärkeimmistä hydrofiilisistä mitokondrioiden antioksidanteista, joilla ylläpidetään hapetus-pelkistys tasapainoa.”
Nuo 1,5 miljardia vuotta sitten syntyneet myrkkyjen torjuntamekanismit pärjäsivät vielä hyvin, kun alkoholia tuli pieniä määriä käyneiden hedelmien ja muun ruoan mukana ja monityydyttymättömiä rasvoja saatiin vain osana kiinteää ruokaa, kuten kalaa, pähkinöitä tai siemeniä. Muinaiset bakteerit eivät mitenkään voineet aavistaa, mikä niitä kohtaisi 1900-luvulla: alkoholia ja siemenöljyjä saisi silloin valtavia määriä suoraan pullosta ja jälkimmäisiä olisi osana lähes kaikkia valmisruokia! Ja kuten ylläolevasta listasta nähdään, 4-HNE – omega-6 siemenöljyjen hapetustuote – tarvitsee neutraloituakseen samoja tekijöitä kuin alkoholikin. Kun molempia tulee yhtä aikaa, tapahtuu torjuntakapasiteetin ylitys ja maksa ’poksahtaa’. Jos taas 4-HNE jää kuvasta pois – kun rottakokeessa monityydyttymättömät vaihdettiin tyydyttyneisiin – pystyivät maksasolut hajottamaan alkoholin. Alkoholi ja siemenöljyjen hapetustuote, 4-HNE, kilpailevat siis samoista neutraloijista – ADH:sta, ALDH:sta ja GSH:sta (alkoholin hajotusmekanismi kuvassa, toimii pääasiassa 2 ensimmäisen avulla, mutta GSH:takin tarvitaan (6)).
Sama syy myös rasvamaksan taustalla
Kun tauti kroonistuu, se alkaa yhä enemmän muistuttaa alkoholiperäistä rasvamaksaa. Sen solut alkavat ilmentää alkoholia metaboloivia geenejä (2): ”Alkoholia metaboloivat geenit, kuten ALDH, olivat koholla NAFLD maksoissa. Geenien ilmentymä vakavassa NAFLD:ssa oli yhtä korkea kuin alkoholihepatitiksessa.”

Rasvamaksan mekanismissa on osallisena myös 4-HNE, aivan kuten alkoholimaksassakin. Rasvojen hapetustuotteet ei-alkoholiperäisen steatohepatitiksen patogenesiksessä (3) kertoo seuraavaa: ”Useiden tutkimusten mukaan HNE pystyy aiheuttamaan insuliiniresistenssin rasvakudoksessa, luurankolihaksissa ja maksasoluissa muuttamalla insuliinista riippuvaista signalointia eri tasoilla.”
”…HNE-sidosten määrä korreloi vahvasti nekro-inflammaation asteen ja fibroosin vaiheen kanssa. Olemme myös raportoineet merkittävää lisäystä mitokondrion HNE-proteiinisidoksissa NASH:in kehityksen yhteydessä.”
Kun maksa alkaa kärsiä kroonisesta, oksidatiivisesta stressistä se tuottaa myös enemmän 4-HNE:tä (4). ”Tässä katsauksessa keskitymme HNE:n molekyylitason mekanismeihin signaloinnissa ja sen säätelytoimintoihin. HNE:n rooli tehokkaana maksavaurion edistäjänä NAFLD:ssä on myös keskustelun aiheena.” ja
”HNE:n neutralointi GST:llä voi vähentyä johtuen GSH:n ehtymisestä, mikä puolestaan voi johtaa HNE:n tasojen kohoamiseen.” ja
”NAFLD tutkimukset rotilla osoittavan HNE:n aiheuttavan steatosiksen, oksidatiiven mekanismin epätasapainon, matala-asteisen tulehduksen, aikaisen mitokondrioiden toimintahäiriön ja -kuoleman (apoptoosi). Nämä voitaisiin estää antioksidanttien riitävällä määrällä.”

Kuten niin monessa metabolisessa häiriötilassa, tässäkin syntyy tyypillinen noidankehä: GSH ehtyy, mikä lisää HNE:tä, mikä ehdyttää entisestään GSH:ta, mikä lisää HNE:tä… Jos glutationin täydennys ei toimi tai se on muuten heikkoa, tämä pahentaa rasvamaksan tilaa. Palaan tähän hieman myöhemmin kohdassa Glutationin ehdyttäjät ja täydentäjät.
Etanolin, etanolista johtuvan aseteldehydin ja 4-HNE:n yhteistä metaboliaa tutkittiin v.1997 (5). Näiden tutkijoiden mukaan 4-HNE ei tuhoaisi maksasoluja sytotoksisuudellaan, vaan se estäisi ALDH:ta toimimasta, mikä puolestaan kerryttää asetaldehydiä maksasoluihin. Tämä voisi olla se alimman tason yhteinen nimittäjä, koska myös rasvamaksassa ALDH-geenit olivat ilmentyneet (2). Vähän samansuuntaisia pohdintoja tarjoaa myös tämä v.2016 yhteenvetoartikkeli (7): ”ALDH2, jota esiintyy maksassa, neutraloi myrkyllisiä aldehydejä, kuten aseteldehydi, 4-HNE ja MDA (syntyvät alkoholista ja rasvojen hapettumisesta) ja joka suojaa oksidatiivisilta vaurioilta.”
Tähän asti läpikäytyjen tietojen valossa näyttäisi siltä, että ALD ja NAFLD ovat lähempänä toisiaan kuin äkkiseltään näyttäisi. Pienintä yhteistä tai yksittäistä nimittäjää niille on kuitenkin hankala nimetä, mutta noiden alussa lueteltujen puolustusmekanismien toiminnan vajaus kuulostaisi aika uskottavalta molemmissa sairauksissa. Ja koska noiden puolustusmekanismien pitämisestä huippuvireessä ei haittaakaan ole, niin selvitetään millä ne sitten saisi toimimaan mahdollisimman tehokkaasti. Sitä ennen katsaus ulkoisiin 4-HNE ja 4-HHE lähteisiin, elintarvikkeisiin.
4-HNE ja 4-HHE:tä myös elintarvikkeista
Elintarvikkeet, joissa on viivakoodi ja jotka tulevat pakkauksessa, on usein kyllästetty monityydyttymättömillä rasvoilla. Hyvä esimerkki on erilaiset marinoidut lihatuotteet. Myös suurimmassa osassa leipiä on tuoteselosteessa mainitty rypsiöljy. Miten ihmeessä ennen osattiin paistaa leipää, kun ei ollut rypsiöljyä?
Ruokateollisuus on jo pitkään tiennyt monityydyttymättömien siemenöljyjen haitat. 1900-luvun loppupuolella niitä muutettiin kovemmiksi hydrogenoimalla (kun kookosöljyä ’ei voinut’ enää käyttää), mutta toinen motiivi niiden kovettamiselle oli tyydyttyneisyysasteen nostaminen – näin saatiin helposti hapettuvat rasvat vakaammiksi ja tuottamaan vähemmän myrkyllisiä hapetustuotteita (aldehydit ym.). Harmi vaan, että teolliset transrasvat eivät olleet kovin terveellisiä, toisin kuin eläinperäiset transrasvat. Rasvojen ja rasvahappojen saannin biomarkkerit (8) vuodelta 2003 kertoo asiasta näin: ”Transrasvoja syntyy luonnostaan märehtimis-prosessissa, mutta valtaosa tulee teollisesta monityydyttymättömien rasvojen hydrogenoinnista niiden vakauden lisäämiseksi ja hapettumisen estämiseksi. Margariinien rasvoista 15-25% voi olla transrasvaa. USA:ssa kulutettu transrasvan määrä lisääntyi viime vuosikymmeninä ja käsittää nyt n. 5% ihmisten rasvavarastoista. Rasvakudoksen keskimääräinen transrasvapitoisuus on alempi EU-maissa kuin USA:ssa.” Tuo oli siis v.2003 USA:ssa. Suomessa transrasvojen määrää lähdettiin alentamaan jo 2000-luvun vaihteessa, nuo hurjat transrasvamäärät margariineissa olivat kyllä todellisuutta Suomessakin vielä 90-luvulla.
Transrasvojen poistuminen elintarvikkeista ei poistanut 4-HNE ja vastaavia myrkkyjä. Tästäkin elintarviketeollisuus on tietoinen ja suomalainen firma Myllyn Paras Finland Oy on jopa hakenut patenttia nimellä: Elintarvikerasvakomponentti, sen valmistusmenetelmä ja sen käytöt. He lienevät ainoa yritys, joka suhtautuu vastuullisesti näihin siemenöljyjen haittavaikutuksiin. Lainaus patentista:
”Hapettumisprosessissa muodostuu erilaisia yhdisteitä, kuten haihtuvia yhdisteitä. Niiden
lisäksi muodostuu muita sekundäärisiä yhdisteitä, joista osan on todettu olevan toksisia
yhdisteitä, kuten 4-hydroksialkenaaleja. Niistä 4-hydroksi-2-nonenaalin (4-HNE) on todettu
olevan sytotoksinen ja mutageeninen, ja se on yhdistetty erilaisiin sairauksiin, kuten ateroskleroosiin, Alzheimerin tautiin ja erilaisiin syöpiin (Csallany ym. 2015). 4-HNE:ta
muodostuu etenkin omega-6 rasvahappojen hapettuessa, joiden määrä monityydyttymättömiä rasvahappoja sisältävissä öljyissä on usein korkea.”
”Erityisesti esillä oleva keksintö soveltuu estämään tyydyttymättömien rasvahappojen hapettumista tuotteiden prosessoinnin ja säilytyksen aikana.”
Tuotakaan patenttia ei tarvittaisi, jos elintarviketeollisuus ryhtyisi uudestaan käyttämään vakaita, tyydyttyneitä rasvoja.
4-HNE ja 4-HHE määriä on testattu
Monityydyttymättömien rasvojen hapettuminen ja sen vaikutus ruoan laatuun ja ihmisten terveyteen -niminen katsaus (9) kuvaa selkeästi prosessin (kuva alla), jossa näitä haitallisia hapetustuotteita elintarvikkeissa syntyy joko entsymaattisesti tai ei-entsymaattisesti. ”Useimmissa tapauksissa PUFAn hapettumisesta aiheutuu makuhaittoja ja ruoan laadun ja hyllyiän vähenemistä. Hapettuminen saattaa aiheuttaa oksidatiivista stressiä ja tulehdusta kun hajoamistuotteita on paljon. Pieninä pitoisuuksina ne saattavat vaikuttaa antioksidatiivisesti.”
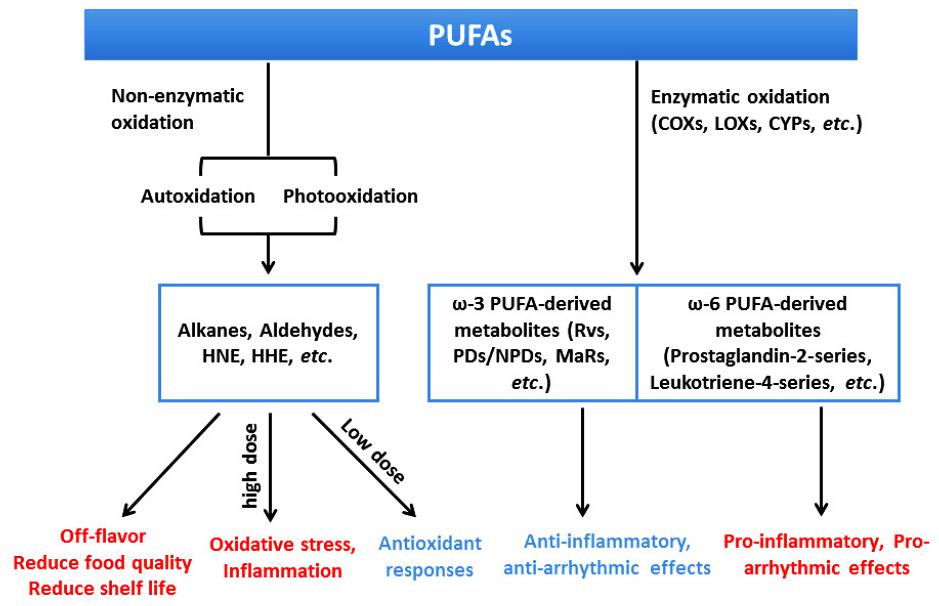
Jos valmisruokia syö paljon, tuo pieni pitoisuus saattaa ylittyä. Helpoimmin se tapahtuu imeväisikäisillä, joilla painoon nähden näitä myrkkyjä voi tulla enemmän kuin aikuiselle. Belgialaiset mittasivat (10) eri elintarvikkeista sekä HNE:n että HHE:n määriä. Yhtenä elintarvikkeena oli myös äidinmaitokorvike (infant formula). Muita olivat perunalastut, naudanliha ja öljy (palmuöljypohjainen sekoitus). HNE:n pitoisuuksissa äidinmaitokorvike oli ykkösenä, ja HHE osalta toisena heti öljyn jälkeen (tutkimuksen taulukko 4). Perunalastut ovat siis terveellisempiä kuin äidinmaitokorvike! Kun otetaan huomioon, että vauva painaa ehkä vain 1/10 aikuisen painosta, altistus on hänelle jopa 10-kertainen. Lisäksi vauvan antioksidanttijärjestelmä ei liene vielä yhtä hyvässä iskussa kuin aikuisella.
Öljyistä HNE ja HHE pitoisuuksia on mitattu sekä 180 asteen kuumennuksen jälkeen (11) että tuoreena. Odotusten mukaan HHE:tä syntyy eniten sellaisiin rasvoihin, joissa omega-3 (ALA) pitoisuus on korkea: pellavansiemen-, rypsi- ja soijaöljyihin. Ehkä hieman yllättäen soijaöljy on ykkösenä myös HNE:ssä (Kuva 2). Rypsiöljy ja pellavansiemen jäivät tämän osalta kärjestä, jossa tietenkin olivat edustettuina enemmän omega-6:tta sisältävät öljyt. Huolestuttavaa sen sijaan on, että näitä tehokkaita myrkkyjä ei yleensä mitata. Tässä tutkimuksessa (12) verrattiin MDA, 4-HHE ja 4-HNE pitoisuuksia perinteisten, käytössä olevien mittareiden (peroksidi- tai anisidiiniarvot) lukemiin. ”MDA, 4-HHE ja 4-HNE olivat mitattavissa tuoreista öljyistä, joiden PV ja AV arvot olivat hyväksytyissä rajoissa. Itsehapettuneissa omega-3 öljyissä MDA oli ylivoimaisesti yleisin toissijainen hapetustuote verrattuna 4-HHE ja 4-HNE:hen. Auringonkukkaöljyssä 4-HNE oli merkittävin toissijainen hapetustuote.”
Joissakin tutkimuksissa on vertailtu pikaruokaravintoloiden ranskanperunoiden tai broilerisuikaleiden sisältämiä HNE jäämiä. Ranskanperunat sisälsivät niitä ylivoimaisesti eniten.
Puolustautuminen
Myrkkyjen vähentäminen
Tärkein toimenpide on tietysti myrkkyjen saannin vähentäminen. Ruokavaliosta vähennetään hapetusstressiä tuottavat aineet minimiin – alkoholi ja siemenöljyt. Jälkimmäisen kohdalla se on helpommin sanottu kuin tehty, koska kasviperäiset omega-6 ja omega-3 ovat osana lähes kaikkia valmisruokia esim. rypsiöljyn muodossa. Isoimman korjauksen voi tehdä kaupan öljyhyllyn äärellä – jättämällä rypsi/rapsi-, auringonkukkaöljyt ja vastaavat hyllyyn. Tilalle voi ottaa (extra-neitsyt) oliiviöljyn. Rasvahyllyjen äärellä vastaavasti jätetään margariinit omaan arvoonsa ja tilalle voi. Kookosöljyt kannattaa valita luontaistuotehyllystä, koska neitsykookosöljyä ei ole hydrogenoitu.
Glutationi (glutathione) neutraloi myrkyn
Glutationi on elimistön tehokkain antioksidantti ja sen ominaisuuksista voi lukea lisää tuossa otsikossa olevien linkkien kautta. Koska suuri osa 4-HNE:stä ja muista aldehydeistä syntyy solujen sisällä niiden solukalvojen ja mitokondrioiden monityydyttymättömien rasvojen hapettuessa, on solun sisällä niitä torjuva antioksidantti ensiarvoisen tärkeä – varsinkin, kun elimistön solukalvot sisältävät sitä enemmän monityydyttymättömiä rasvoja, mitä enemmän ihminen on niitä elinaikanaan syönyt. Joidenkin arvioiden mukaan kestää vähintään 2 vuotta muuttaa omien solujensa rasvatasapaino (siis jos se on tyypillinen länsimaisen ihmisen rasvaprofiili) takaisin luonnonkansojen tasolle.
4-HNE:n englanninkielisessä Wikipedia artikkelissa sen detoksifikaatiosta glutationin avulla kerrotaan näin: ”Pieni ryhmä entsyymejä on kehittynyt erityisesti 4-HNE:n neutralointiin ja poistamiseen soluista. Tähän ryhmään kuuluvat glutationi-s-transferaasit (GST:t) … ja aldehydi-dehydrogenaasi (ALDH). Tiettyyn rajaan asti nämä entsyymit pitävät 4-HNE:n pitoisuuden solussa aisoissa, mutta jossain vaiheessa rajan ylittyessä niiden teho ei enää riitä ja solun kuolema on väistämätön.”
Sikäli kuin noissa aikaisemmissa tutkimuksissa olleet viittaukset siihen, että 4-HNE riittävän suurina pitoisuuksina blokkaa myös ALDH:n pitävät paikkansa, niin järkevintä olisi silloin keskittyä HNE:n pitämiseen mahdollisimman alhaisena. Se varmistaa myös ALDH:n toiminnan.
Glutationia on kaikissa soluissa, mutta erityisen runsaasti sellaisissa soluissa, joissa on mitokondriot – kuten maksasoluissa. Maksa jopa lähettää GSH:ta verenkiertoon ja sappinesteen mukana suolistoon (13), missä se suojelee suolen epiteelisoluja esim. ruoan mukana tulevan 4-HNE:n hyökkäyksiltä. Maksan heikosti toimiva glutationisynteesi, vaikkapa NAFLD:n vuoksi, voi siis vaikuttaa myös suoliston terveyteen.
Glutationin ehtyminen on todellinen uhka NAFLD:ssa – ainakin tässä kokeessa (14), jossa hiirille aiheutettiin rasvamaksa. Kahdeksan viikkoa runsasrasvaisella ja -fruktoosisella ruokavaliolla pudotti hiirten maksojen glutationitasot noin puoleen (kuva alla).

Kun puolustuskyky laskee, avautuu aldehydeille ovet vapaasti mellastaa maksasoluissa ja aiheuttaa niille vaurioita.
Glutationin ehdyttäjät ja täydentäjät
Nuo edellä käsitellyt aldehydit ovat tietysti tärkein haaste glutationin riittävyydelle. Runsaan kulutuksen lisäksi puutos voi syntyä liian heikosta GSH-synteesistä.
Ehdyttäjät
Katsauksessa 4-HNE – bioaktiivinen rasvojen hapetustuote (15), esitetty ao. kuva näyttää, miten tämä myrkyllinen aldehydi lisääntyy iän karttuessa. Kenties juuri tästä syystä alkoholin sietokin heikkenee vanhemmiten ja taustalla on luultavimmin antioksidanttimekanismien tehon heikentyminen. Glutationia ei vaan enää synny yhtä paljon kuin nuorempana. Tätä voi lieventää jättämällä omega-6 pitoiset tuotteet hyllyyn. Silti pieni määrä alkoholia oli hollantilaisessa tutkimuksessa (16), Alkoholin kulutus myöhemmällä iällä ja pitkäikäisyys, 36% parempi tae saavuttaa 90v ikä kuin raivoraittius. Liiallinen ryyppääminen toimi päinvastoin.

Glutationin synteesi -nimisessä katsauksessa (17) on lyhyt luettelo glutationia ehdyttävistä muista tekijöistä: ”…alentunutta GSH synteesiä esiintyy ikääntymisen, diabeteksen, fibroottisten sairauksien (ml. kystinen fibroosi ja keuhkofibroosi), endotoksemian ja useiden maksan toimintahäiriöiden, kuten kolestaasi ja alkoholin aiheuttama maksavaurio, yhteydessä.”
Täydentäjät
Koska glutationi on ’yhdistelmä’ aminohappoja, sen lisäys onnistuu luonollisimmin riittävällä proteiinin nauttimisella. 20 sivuisessa artikkelissa Katsaus ruokavalion glutationia tukeviin ravinteisiin (18) on mielenkiintoinen taulukko 1, jossa on lueteltu elimistön tiloja ja sairauksia, jotka ovat yhteydessä alhaisiin glutationin tasoihin; mielenkiintoinen lista, kannattaa käydä lukemassa. Tässä käsiteltävään aiheeseen jotenkin liittyviä niistä ovat mm. ikääntyminen, krooninen maksasairaus, diabetes ja verenpaine. Tuo tukee hyvin kehotusta, että vanhemmalla iällä pitäisi lisätä proteiinin syöntiä.
NAC on runsaasti kysteiiniä sisältävä yhdiste. Siitä todettiin jo olevan hyötyä parasetamolin ja alkoholin haittojen torjumisessa, mutta sitä on kokeiltu hoitona myös itse rasvamaksaan (19, 20).
D-vitamiini (21, 22) ja magnesium (23-25) kannattaa myös pitää hyvällä tasolla glutationin riittävyyden takaamiseksi ja myös siksi, että ne tukevat toistensa toimintaa. C-vitamiinista on hyötyä tässäkin (26).
Ketogeneesi
Kirjoituksen edellisissä osissa tuli viitatuksi ketoosiin tehokkaana rasvamaksan lievittäjänä ja näyttäisi siltä, että senkin vaikutus välittyy – ehkä suureltakin osin – glutationin kautta. Se nimittäin lisää glutationia (27-30). Ketoosia hyvin tehostava kookosöljykin näyttäisi vaikuttavan glutationin kautta (ainakin osittain (31-33)).
Yhteenveto
Alkoholimaksa ja rasvamaksa näyttäisivät edelläolevan valossa olevan aika pitkälle maksan glutationivarastojen ehtymisestä johtuvia sairauksia. Ja maksan (ja muiden elimien) glutationia ehdyttävät tehokkaasti siemenöljyt. Kanadalainen Amy Botta, jonka v.2017 julkaistussa väitöskirjassa (34) GSH on mainittu 323 kertaa, toteaa yhteenvetonsa lopussa:
”Kaiken kaikkiaan, nämä tulokset osoittavat GSH:n säätelyhäiriön olevan omega-6 PUFAn aiheuttaman tulehduksen keskiössä. Tämä saattaa olla uuden, länsimaita riivaavan, PUFAan liittyvän kardiotoksisuuden aiheuttaja.”
PS. COVID-19 sairaudestakin näyttäisi selviävän paremmin, jos glutationivarastot ovat täynnä. (35-37).
VIITTEET
1) Role of lipid peroxidation derived 4-hydroxynonenal (4-HNE) in cancer: Focusing on mitochondria
3) Lipid oxidation products in the pathogenesis of non-alcoholic steatohepatitis
4) 4-Hydroxynonenal (HNE) and hepatic injury related to chronic oxidative stress
6) Glutathione Depletion and Recovery After Acute Ethanol Administration in the Aging Mouse
7) The longitudinal effect of the aldehyde dehydrogenase 2*2 allele on the risk for nonalcoholic fatty liver disease
8) Biomarkers of Fat and Fatty Acid Intake, 2003
9) Oxidation of Polyunsaturated Fatty Acids and its Impact on Food Quality and Human Health
10) Development of a sensitive and accurate stable isotope dilution assay for the simultaneous determination of free 4-hydroxy-2-(E)-nonenal and 4-hydroxy-2-(E)-hexenal in various food matrices by gas chromatography–mass spectrometry
11) The distribution of 4-hydroxy-hexenal and 4-hydroxy-nonenal in different vegetable oils and their formation from fatty acid methyl esters
12) Amounts of the reactive aldehydes, malonaldehyde, 4-hydroxy-2-hexenal and 4-hydroxy-2-nonenal in fresh and oxidized edible oils do not necessary reflect their peroxide and anisidine values
13) Dysregulation of glutathione synthesis in liver disease
15) 4-Hydroxy-nonenal—A Bioactive Lipid Peroxidation Product, 91s
16) Alcohol consumption in later life and reaching longevity: the Netherlands Cohort Study
18) A Review of Dietary (Phyto)Nutrients for Glutathione Support
19) The Potential Use of Metabolic Cofactors in Treatment of NAFLD
20) N-Acetylcysteine Improves Liver Function in Patients with Non-Alcoholic Fatty Liver Disease
21) Vitamin D upregulates glutamate cysteine ligase and glutathione reductase, and GSH formation, and decreases ROS and MCP-1 and IL-8 secretion in high-glucose exposed U937 monocytes
22) Glutathione as a Marker for Human Disease
23) Effects of magnesium supplementation on the glutathione redox system in atopic asthmatic children
24) Magnesium deprivation decreases cellular reduced glutathione and causes oxidative neuronal death in murine cortical cultures
25) Oral Magnesium Potentiates Glutathione Activity in Experimental Diabetic Rats
27) The ketogenic diet increases mitochondrial glutathione levels
30) Ketogenic diets, mitochondria, and neurological diseases, 18 sivua
33) Dietary Supplementation with Virgin Coconut Oil Improves Lipid Profile and Hepatic Antioxidant Status and Has Potential Benefits on Cardiovascular Risk Indices in Normal Rats
37) The Role of Glutathione in Protecting against the Severe Inflammatory Response Triggered by COVID-19
 Ari Kaihola
Ari Kaihola
Kirjoittaja on yli 15 v harrastanut terveysasioiden tutkimista ja opiskelua omatoimisesti tavoitteena tieteellisten havaintojen hyödyntäminen oman terveyden ylläpitoon. Tärkeintä terveyden hoitoa on ennaltaehkäisy ja siinä puhdas ravinto. Hippokrateen sanoin – olkoon ruoka lääkkeesi ja lääke ruokasi.



Paluuviite:Alkoholi, maksa ja siemenöljyt, Osa 1 – Turpaduunari
Jos ylläoleva kirjoitukseni kiinnosti, tämä tuore 10min ‘luento’ kannattaa myös katsoa. Sen nimi on Glycine + N-Acetyl Cysteine Supplementation Increases Lifespan ja siinä kerrotaan glutationin pitoisuuksista ja niiden yhteydestä elinaikaan. Mielenkiintoinen havainto oli, että lähes 100-vuotiailla glutationin (GSH) taso oli korkeampi kuin 67-vuotiailla (n. 8:30 kohdalla, 1.06 vs 1.57). Kaikki viitatut tutkimukset ensimmäistä, 17.8.2022 julkaistua tutkimusta lukuunottamatta, ovat vapaasti luettavissa sivulla julkaistuista linkeistä.
Tiivistäen voisi todeta, että glutationin tasot yleensä ovat ikääntyessä aivan päinvastaiset kuin artikkelini otsikkokuvan graafissa kuvattu HNE – poikkeuksena tietenkin ne lähes 100-vuotiaat, jotka jollain konstilla pystyvät säilyttämään glutationin tasonsa korkealla.
https://michaellustgarten.com/2022/08/21/5027/
Paluuviite:Alkoholi, maksa ja siemenöljyt, Osa 2 - Turpaduunari
Paluuviite:Alkoholi, maksa ja siemenöljyt, Osa 3 - Turpaduunari
Mercolan artikkeli 31.10. käsitteli myös siemenöljyjä. Siellä oleva viite (11) 1966 julkaistuun tutkimukseen täsmentää siemenöljyjen poistumista elimistöstä. Ne eivät palaa lähtötasolle vielä 2 vuodessa, vaan niiden puoliintumisaika on jokseenkin tuo.
“The half-time of this function is 680 days.”
“Hirsch et al. arrived at a similar estimate, 350-750 days, for the half-time of depot fat in the human adult”
The Case Against Processed Vegetable Oils
https://articles.mercola.com/sites/articles/archive/2020/10/31/vegetable-oil-omega-6.aspx
“The take-home message here is that a proper ketogenic diet must be based on healthy saturated fats, not destructive vegetable seed oils that are loaded with LA.
Eating a high-fat diet, when the fats are primarily LA from processed vegetable and seed oils, is far worse than eating a chronic high-carb diet. The type of fat is of crucial importance, as it impacts your mitochondrial, cellular and metabolic functioning.”
Tucker Goodrich on julkaissut tänään omia artikkeleitani sivuavan postauksen. Hänen mukaansa LA ei ole EFA (Esssential Fatty Acid l. välttämätön rasvahappo) ja tukee väitettään parilla tutkimusviitteellä.
Kardiolipin saa kohtuullisesti palstatilaa ja HNE:n ja GSH:n yhteyttä käsitellään myös ja osittain mennään syvemmälle HNE:n kykyyn vahingoittaa sekä GSH:ta että ALDH:ta:
“Depressed levels of GSH indicate excessive production of HNE, typically from LA. Aldehyde dehydrogenase (ALDH) is also involved in detoxifying HNE, HNE has the unique ability to damage both GSH and ALDH, thus breaking its own regulatory system.”
Linoleic Acid and Its Metabolites, a Primer
http://yelling-stop.blogspot.com/2020/11/linoleic-acid-and-its-metabolites-primer.html
Hyvä ajoitus! Hyvä artikkeli. Kyllä näitä omegoita tarvitaan, mutta pienessä määrin. Niin pienessä, ettei niitä tarvitse erikseen jahdata, koska ne ovat kaikkialla. Esim. Fineli:
– tali 6% O-6, 1% O-3 siis sama grammoissa per 100g. Never mind tyydyttyneet tai monoepästabiilit…
– laardi 2,8% O-6 ja 0,5% O-3 jne. Never mind tyydyttyneet tai monoepästabiilit… suhde on about oikea 1 miljoonaa vuotta
Koska se tarve näille molemmille “välttämättömille” on YHTEENSÄ aboutmax 3%, riittää että syöt monipuolisesti RUOKAA. Mitä tahansa rasvaa suuhusi työnnät, siinä on KAIKKI rasvan fraktiot. Ml. ne “välttämättömät”. Please älä tee tätä läpinäkyvillä muovipulloilla…Vaaka keikahtaa O-6 puolelle liikaa. Liika O-6 suhteessa kaikkeen muuhun (tutki historiaa), on se ongelma. Älä käsittele kaikkia solupintojasi “vernissalla” eli omega-6 runsailla siemenöljyillä, joka on vasta 100v vanha ruokakeksintö. Ennen vernissaa… oli vaikeampaa kehittää degeneratiivisia sairauksia, muita sairauksia kyllä.
JR
Ps. Jos välttää rasvaa totalitäärisesti a’la Pritikin (tai perunadieetti), niin saa myös tuloksia aikaan -rikkoutuneen metabolian säädössä. Rasvan ja hiilihydraatin YHTAIKAINEN runsaus ei esiinny luonnossa kuin äidinmaidossa ja muutamissa pähkinöissä. Tai syksyn sadonkorjuuaikaan… Nykyihmisen luonnon oloissa, tämä “sadonkorjuu” onkin kaiken aikainen oletusarvo… värikäs paketti viivakoodilla.
Laaja hyvä yhteenveto, voisikohan siihen mitään enää lisätä? Enter MEOS, microsomal ethanol oxidation system.
Alkoholista puhuttaessa, pitäisi määritellä kohtuullinen ja kohtuuton annos. Kohtuullisena päiväannoksena on kai pidetty esim. 2 lasillista viiniä, 32 cl jossa on 32g etanolia, tai 2 tuoppia olutta, n. 40g etanolia. Onko puoli litraa viiniä eli 50g etanolia jo kroonisesti kohtuutonta? Entä jos sen juo usean tunnin aikana, versus kulauttaa puolessa tunnissa?
Arin kuvaileva normaali polttoketju alkoholille oli asetaldehydi – > asetaatti. Jos kulutus kasvaa krooniseksi, tämä ei enää riitä vaan apuun tulee MEOS ja tässä merkittävin entsyymi CYP2E1 määrä lisääntyy. Nyt alkoholin poltto kasvaa, mutta sillä on hintansa; ROS kaikissa olomuodoissaan lisääntyy. Asetaldehydin lisäksi alkaa muodostua 4-HNE, MDA, LOOH lipidiperoksideja eli kaikkia vain omega-6 peräisin olevia hajoamismyrkkyjä. Tämä on kuitenkin se mekanismi, millä sekä alkoholin sieto paranee että tarvittavan alkoholin määrä kasvaa.
Ja sivuvaikutus on tietenkin antioksidanttipuolustuksen tarpeen kasvu, ja eturivin sotilaan GSH kuluminen.
Jos nyt pannaan yhteen ”sydänterveellisen” siemenöljyn suurehko kulutus yli rakennemolekyyli- ja tulehdusreaktiomolekyylitarpeen, niin maksan vaivoiksi nämä kasaantuvat. Itse asiassa, historiallisesti maksa on tykännyt imuroida näitä suht’ harvinaisia O-6 ja O-3 molekyylejä.
Krooninen alkoholin ylikulutus -alkoholismi- ja krooninen siemenöljyn ylikulutus – rypsismi? -aiheuttavat raaka-aineen ROSsille kahdesta suunnasta. Maksa tuntuu sietävän vain toisen, mutta kahden rintaman hyökkäys tuntuu olevan liikaa -hiirille. Ja hypoteesini on se, että sama tekijä jaottelee ihmisetkin kahteen -alkoholistit ehjällä maksalla vs. uupuvalla maksalla. Alkoholin sisältävä sokeri tuo tähän uuden dimension, tuskin positiivisen sellaisen.
Joten: Jos otat, älä ota epästabiileja O-6 rasvoja.
JR
PS. Kerran katsahdin siihen, miten alkoholi ja fruktoosi elävät yhdessä. Fruktoosin käsittely maksassa on hyvin analogista alkoholin kanssa, tietyin edellytyksin. Oletus oli tuplaharmi. Ehkei niinkään, sillä alkoholi palaa nopeammin yhdessä fruktoosin kanssa (mutta mekanismista ei tietoa). Emme siis tule näkemään uutta savolaista diabeetusdrinkkiä ”votkoo ruktoosilla”. Alkoholin juomisen idea on kai tulla ja pysyä sopivassa humalassa?
PS2. Varmaan yksilöllinen raja kohtuullisen ja kroonisen kulutuksen välillä
JR.
Tuosta alkoholin ja sokerin sisältämän fruktoosin (50%) samankaltaisuudesta on puhunut myös professori Robert Lustig. Hän on kirjoittanut aiheesta artikkelin
Fructose: It’s “Alcohol Without the Buzz”
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3649103/
ja mainitsee saman asian myös suuren suosion saaneessa luennossaan Kalifornian yliopistolla – Sugar, the bitter truth – jota on katsottu jo 11 miljoonaa kertaa (fruktoosia ja maksaa koskeva osuus alkaa n. 43min kohdalla ja alkoholi tulee kuvaan mukaan 52min jälkeen + sen vaikutukset maksaan; 57min jälkeen päästään vihdoin fruktoosin samankaltaisiin vaikutuksiin alkoholin kanssa).
https://www.youtube.com/watch?v=dBnniua6-oM
… joten ei ole ihme, että sokeri tuottaa maksalle samanlaisia ongelmia kuin alkoholikin.
Kiitos Ari, lasten alkoholi todellakin. Tuloksena rasvamaksa ilman humalaa, ennen kuin pääsee laillisesti rällästämään? Kohtalon karkeinta ivaa?
Jos puhutaan alkoholista ja fruktoosista niin kihti nousee valaisevana sairautena esiin (olet tästä varmasti kirjoittanutkin). Bergerillä ja Georgia Edellä on asiasta hyviä kirjoituksia, tässä https://www.diagnosisdiet.com/full-article/does-meat-cause-gout hyviä kokemuskommentteja huom!
Alkoholi ja fruktoosi molemmat uuvuttavat maksan ATP:tä ja hajoittavat sen puriineiksi, ja sitä myötä lisäävät ureahappoja tms (molemmista reaktiopoluista puuttuu rate liminting jarru, kaikki käsitellään heti). Sokerin glukoosiosa vaikuttaa insuliinin kautta; insuliini käskee munuaisia pitämään ureat kierrossa eikä päästämään läpi. Täydellinen kihtigeneraattori: Portviini 20% alkoholia yli 10% sokeria. Väkevien viinien Cokishan se siinä! Englantilaisten suosikki, tämä kai oli se pullo maalausten pöydällä keskiajalta…
Puriineja on siis kaikissa whole food ruoissa (niiden soluissa), ja erityisesti eläinperäisissä (paljon tiheitä soluja). Jos haluaa puriinivapaita aka solurakenteista vapautettuja ruokia, niin junk food ml. hedelmämehut täyttävät tämän vaateen!
Jos hyppäämme Terveyskirjaston ohjeisiin “vapaasti syötävistä”, niin
Viljatuotteet (leipä, puurot, hiutaleet jne.) (glukoosia ketjussa)
Maitotaloustuotteet (maito, piimä, jogurtit, juusto)
Kaikki hedelmät ja hedelmämehut (glukoosi+fruktoosi)
Kananmuna ja munaruuat (missä kolesterolivaroitus?)
Ruokaöljyt, margariinit, voi (potkut sille joka päästi voin läpi! huolimatonta)
Kahvi, tee, kaakao
Useimmat kasvisruuat (peruna, salaatti, kaali, tomaatti, kurkku, kurpitsa, sipuli, porkkana, punajuuri, retiisi, selleri)
(miedosti glukoosia ketjussa)
Arvaa, onko sokerista / fruktoosista mitään varoitusta… tusinaterveystiedon jakaja ei koskaan petä! https://www.terveyskirjasto.fi/terveyskirjasto/tk.koti?p_artikkeli=dlk00032
JR
JR, jännä, että otit tuon fruktoosin ja kihdin esille ja vielä viittasit Terveyskirjastoon. Tässä melko tasan 4v vanhassa artikkelissani kihdistä & insuliiniresistenssistä kopioin otteen Terveyskirjaston kihti-sivulta:
‘Oikeaakin tietoa löytyy – ehkä paras lyhyellä etsimisellä löytämäni sivu kuuluu Terveyskirjastolle: ”Korkea veren insuliinipitoisuus lisää siten veren uraattia ja suurentaa kihdin syntymisen vaaraa. Tämä selittää metaboliseen oireyhtymään liittyvän hyperurikemian ja kihdin syntymisen paremmin kuin runsaasti puriineja sisältävä ruoka.”’
Jostain syystä heille on tullut tarve poistaa tuo fruktoosin ja kihdin yhteys sivuiltaan. Miksiköhän?
https://turpaduunari.fi/insuliiniresistenssi-kaikkien-elintasosairauksien-aiti-osa-3/
Näyttöähän fruktoosin osuudesta kihtiin on vaikka kuinka paljon:
https://scholar.google.com/scholar?start=0&q=fructose+gout&hl=en&as_sdt=1,5&as_vis=1&lookup=0
Kiitos Ari, mun piti ihan ctrl F katsoa, onko insuliini sokeri gluko frukto jotenkin mainittu terveyskirjaston artikkelissa. Ei ole. case closetissa. Sinne samaan pönttöön voisi huuhdella tämänkin artikkelin. Todennäköisesti myös terveyskirjaston artikkeleista suurimman osan, mulle se on se viimeinen paikka maailmasta, josta TIETOA etsin. Jos etsisin fake news, harhatietoa, tai mitä tahansa luulotietoa -duodecim, here I come!
Ikävä kyllä, tämä on kai lääkäreiden tietovirran vuoksen koski…
🙁 JR
PS. katsoin sen patenttihakemuksen läpi, interesting. Kuinka tehdä virtuaalinen chylomicron, joka suojelee hajoavaa terveellistä sydänterveellistä välttämätöntä rasvahappoa ympäröivältä maailmalta. Tätä ongelmaa ei ollut silloin, kun ympäröivä maailma oli ihan sama, mutta tämä luonnottoman yliannosteltu omega-6 siemenöljy puuttui! Sinä päivänä kun tämä ilmestyy kahviin, mainittiin patentissa, lopetan kahvin juomisen.
Fruktoosin ja alkoholin rooli on todennäköisesti se tärkein. Itse tunnen henkilökohtaisesti kihdistä kärsineen henkilön, joka nimenomaan lisäämällä puriinipitoista ruokaa ja jättämällä kaiken muun pois sai taudin kuriin (paljon lihaa).
Kevin Stock pohtii problematiikkaa hyvin: https://www.kevinstock.io/health/high-protein-diets/
Kiitokset linkistä, Hannes!
Luin kihtiä käsittelevän osan ja aika pätevää tietoa ja hyviä linkkejä asiaa tukeviin tutkimuksiin löytyi. Kirjoittaja korosti insuliiniresistenssin aiheuttamaa munuaisten toiminnan muutosta – syy ei ole puriinipitoinen ruoka, vaan puriinien heikentynyt eritys munuaisista.
Samaan tapaan liiallinen insuliini estää myös natriumia erittymästä. Molemmat ovat yhteydessä verenpaineeseen. Magnesiumia puolestaan päästetään liiankin kanssa ulos, kun verensokeri on korkea. Tämä nostaa vielä entisestään verepainetta.
Korjaus kihtiin ja verenpaineeseen saavutetaan hyvin pitkälti laskemalla insuliinia ja verensokeria, ei puriineja ja suolaa vähentämällä. Kun metabolia toimii niin kuin sen pitää, munuaiset päästävät natriumin ja puriinit ulos, mutta pidättävät magnesiumia.
” solukalvojen fosfolipidit, jotka sisältävät linolihappoa (LA, 18:2 n-6) ja arakidonihappoa (AA, 20:4 n-6) katsotaan olevan pääasiallinen 4-HNE:n lähde….mitokondrioiden kardiolipinin hapettuminen johtaa myös huomattavaan määrään 4-HNE:tä”
LovetohAte eli LA 18:2 on siis merkittävä rakenneosa loukalvoilla ja mitokondriakalvoilla, josta kardiolipin löytyy eri komplexien ja electron transport chainin läheisyydestä. Rakenneosa on siis pakosta syöty jossain vaiheessa. Jos rakenneosaa syö bulkkina ja yrittää tehdä siitä poltettavaa rasvaa, niin kuvaillut reaktiot voivat osua niihin rasvapalleroihin (myös maksan solulimassa)?
Kardiolipin on kuin mega-trigly: jos trigly olisi 3 piikkinen haarukka, niin piikit ovat vaihtelevia rasvahappoja (stabiileja, monoepästabiileja tai polyepästabiileja) ja glyseroli on kädensija. Kardiolipin on nelipiikkinen, ja kädensijan välissä on iso molekyyli “lusikkana”. Ja pointsihan oli se, että nisäkkäillä kaikki neljä piikkiä ovat LA:ta ! (harvoin 18:1).
Tarvitaan vain ROS epätasapaino -joko liikaa happiradikaaleja tai pilalle menneiden moniepästabiilien rasvojen hajoamistuotteita, versus liian vähän antioksidanttia -ja syöksykierre on valmis. Labrassa ilman antioksidantteja, hajoamistuotteet sekä hajonnut epästabiili rasva ovat itsessään ROSseja -reaktio menee viimeiseen asti. Solussa näin ei oikein pääse käymään… better play safe. Jätä kaikki kirkkaisiin muovipulloihin pakatut kellertävät siemenöljyt hyllyyn.
JR
https://www.mtvuutiset.fi/makuja/artikkeli/kilot-kuriin-rasvan-avulla-oliivioljysta-paljastui-yllattava-fakta/5778140#gs.ljiil7
Emännälle pisti silmään tällainen uutinen 2016 vuodelta :D.. Mitäs herrat mieltä tuosta väitteestä, onko tullut kyseinen tutkimus vastaan? Vähän oudolta kuulostaa kyllä.
nopeasti ilman että lukee itse tutkimusta. Ihminen on syönyt RUOKAA pähkinöiden ja oliivien / oliiviöljyn muodossa vuosituhansia. Näissä kaikissa on saturoituneita, “oliiviöljyjä” ja polyepästabiileja PUFA rasvoja suhteissa, jotka ovat muuttuneet viimeisen sadan vuoden aikana PUFAn suuntaan. Tänä päivänä ÖLJY mielletään kirkkaaseen muovipulloon pakattuun PUFA-6 enemmistöiseen rasvaan. Kaikessa pakatussa ruoassa ja ravintolaruoassa PUFA-6 on piiilossa mutta merkittävässä asemassa.
Jos “tulehdus” tai mikä tahansa ikävyys on “lisääntynyt”, niin vertailukohta 100v sitten oli ilman yli-PUFAa tai yli -SOKERIa joka paikassa. PUFA-6 rooli on tulehduksen eli tervehtymisen edistäminen; Omega-3 taas toimii vastavoimana kun “pöpö” on tapettu ja tarvitaan toipumista ja tulehduksen lopetusta. Voima ja vastavoima, tämä tulee vastaan kaikessa biokemiassa.
Jotenkin on vaikeaa uskoa, että ihmiskunta kärsi PUFA puutteesta miljoona vuotta, kunnes keksittiin kemiallinen uuttomenetelmä kasvien rasvojen liottamiseksi ja PUFA-6 määrän hurjaksi lisäämiseksi dieetissä. Maailman sydänjärjestöt toki uskovat tähän ihmeeseen?
Ylipäätään iltalehtien ml. hs toimittajien peer review tai muu yleinen ymmärrys ….make your pick. Mitään suodatinta ei käytännössä ole, tai ne soittaa ravitsemusterroristi -tutulle.
Olen myös yllättynyt tuloksista. Epidemiologia, siitä lottopallokoneesta voi saada mitä vain! Context matters, on eri asia tutkia ylipainoisia kuin normaalipainoisia, T2D vs. terveet, ja pitkään kypsyvä esidiabetes (näkymättömissä) viiraa tuloksia T2D suuntaan.
Ehkä joku muu voisi lukea tutkimuksen,
JR
Heh! Onneksi ollaan päästy miljoona vuotta kestäneestä PUFAn puutteesta, JR! Oli jo aikakin…
Kyseessä on kaksi tutkimusta yhdistävä tutkimus, Erythrocyte linoleic acid, but not oleic acid, is associated with improvements in body composition in men and women
Tutkimus ei käsitellyt omega-6 (LA) hapetustuotteita lainkaan ja ainakin alussa esitetty hypoteesi näyttää lukkoon lyödyltä tutkimuksen lopputulokselta: “We hypothesized that increased LA is associated with higher lean mass and decreased trunk adipose mass, insulin resistance, and inflammatory markers in men and women. Our primary goal was to determine the relationship of LA status in nonsupplemented individuals with aspects of body composition, insulin resistance, and inflammation.”
Kaikki osallistujat olivat lihavuusrajalla – naiset hieman alle BMI 30 ja miehet hieman yli. Riippumatta siitä mitataanko LA-pitoisuus verisoluista (kuten tässä n.11% pitoisuus) vai plasmasta, niin yleensä se korreloi ruumiinpainon kanssa. Jostain syystä tutkimus kuitenkin jätti tämän korrelaation kertomatta. Rasvavarastot keskivartalon lihaksistossa olivat alemmat korkeammilla LA-pitoisuuksilla. Se on tietysti hyvä asia. Mutta jos rasvavarastot kertyvät muualle sitäkin enemmän ei sekään ole kovin hyvä juttu. Kaiken lisäksi korkea LA-pitoisuus lisää 4-HNE:n syntymistä ja tämä puolestaan on yhteydessä mm. sydämen vajaatoimintaan:
Circulating levels of linoleic acid and HDL-cholesterol are major determinants of 4-hydroxynonenal protein adducts in patients with heart failure
ja omega-6 on yhteydessä aortta-valtimon plakkien muodostumiseen:
Dietary polyunsaturated fatty acids and composition of human aortic plaques (Lancet 1994)
“Positive associations were found between serum and plaque omega-6 (r=0.75) and omega-3 (r=0.93) polyunsaturated fatty acids, and monounsaturates (r=0.70), and also between adipose tissue and plaque omega-6 polyunsaturated fatty acids (r=0.89). No associations were found with saturated fatty acids. These findings imply a direct influence of dietary polyunsaturated fatty acids on aortic plaque formation and suggest that current trends favouring increased intake of polyunsaturated fatty acids should be reconsidered.”
Vaikka keskivartalon rasvaa olisikin vähemmän, sen koostumus on muuttunut jyrkemmin linolihappopitoiseksi sitten 60-luvun kuin muu rasvakudos – sen lisäksi, että kaikki rasvakudos on tuplasti LA-pitoisempaa. Tämä ei voi olla kovin hyvä asia (Figure 1 B):
Increase in Adipose Tissue Linoleic Acid of US Adults in the Last Half Century
Vaikka Suomessa tilanne ei todennäköisesti ole ihan yhtä huono kuin tuossa USA:n aikuisilla, siemenöljyjä kannattaa välttää ja kalasta peräisin olevaa omega-3:kin on syytä nauttia vain kohtuudella. Se tehoaa paremmin, kun siemenöljyjä tulee vähemmän.
Ari: täsmentäisitkö mitä tarkoitat tällä KOHTUUDELLA!…”siemenöljyjä kannattaa välttää ja kalasta peräisin olevaa omega-3:kin on syytä nauttia vain kohtuudella.”
Kiitos!
Osassa 3 kävin läpi monityydyttymättömien rasvojen hapettumisesta syntyvät aldehydit, 4-HNE ja 4-HHE. Jälkimmäisiä syntyy omega-3 rasvoista, kuten kasviperäinen alfalinoleenihappo (ALA, 11% rypsärissä), mutta myös niistä terveellisemmistä, eläinperäisistä omega-3:sta, EPA ja DHA. Molemmat hapetustuotteet ovat yleisesti ottaen yhtä myrkyllisiä. Lisäksi löytyi viitteitä 4-HHE:n suuremmasta myrkyllisyydestä maksalle. Kun omega-6:tta ei sisälly ruokavalioon kuin vähän, saavutetaan O6/O3 tasapaino vähemmällä monityydyttymättömien rasvojen kokonaismäärällä. Tästä on etuna se, että myös niiden hapetustuotteita tulee vähemmän ja haitat luonnollisesti vähenevät.
Käytännön esimerkkinä voisi olla se, että omega-6 siemenöljyjen jäätyä pois ruokavaliosta henkilö tarvitseekin enää puoli teelusikallista kalanmaksaöljyä päivässä entisen yhden sijaan. Tämän voi toteuttaa ottamalla sen teelusikallisen joka toinen päivä. Monityydyttymättömien kokonaismäärä vähenee, samoin riski niiden hapettumisesta.